脂质纳米粒(LNP)递送RNA药物全过程+如何设计LNP
脂质纳米粒(LNP)递送RNA药物全过程+如何设计LNP!
前言
脂质纳米粒(LNP)是一种具有均匀脂质核心的脂质囊泡,广泛用于小分子和核酸药物的递送,近因其作为COVID-19mRNA疫苗递送平台的巨大成功而备受关注。由mRNA诱导的瞬时蛋白表达的应用远不止传染病疫苗,在癌症疫苗、蛋白质替代疗法和罕见遗传病的基因编辑组件等也具有巨大的潜在应用价值。然而,裸露的mRNA本身极不稳定,易被核酸酶和自水解而快速降解。LNP的封装可以保护mRNA不受细胞外RNA酶的影响,并协助mRNA的胞内递送。2021年8月,Gaurav Sahay等在Accounts of Chemical Research上发表综述,讨论了LNP在RNA递送中的核心作用,对LNP的设计及其更广泛的应用具有重要的借鉴意义。
介绍
近年来,脂质纳米粒(LNP)已成功作为RNA疫苗和疗法的递送平台。裸露的RNA是一种带负电荷的亲水性大分子,由于细胞膜的静电排斥,难以进入细胞,且易被无处不在的RNA酶迅速降解。因此,需要保护性外壳才能进入细胞。因为细胞膜主要由脂质组成,利用脂质囊泡包封RNA可通过细胞膜并将RNA释放到细胞质中。因此,囊泡首先应该是一种带正电的脂质,能够结合带负电的RNA。然而,由永久性阳离子脂质组成的囊泡由于能与带负电的细胞膜发生静电作用而引起细胞毒性,脂质结构已经发展成为能够对内体酸性环境响应而带正电荷的分子。
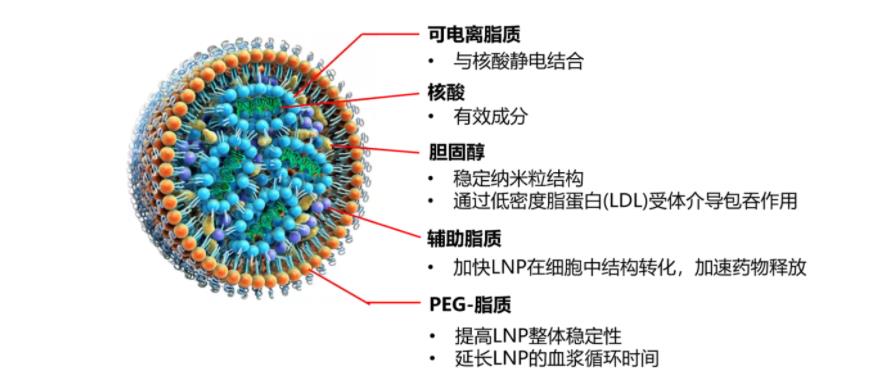
图1:LNP的结构
目前,LNP由结构脂质(模拟细胞膜并屏蔽正电荷)和聚(乙二醇)修饰脂质(防止LNP聚集和与生物环境发生不必要的相互作用)。个siRNA-LNP药物Onpattro获得FDA批准,mRNA-LNP COVID-19疫苗(Comirnaty)的成功以及Moderna的COVID-19疫苗获得紧急使用授权(EUA)是该领域的里程碑性事件。基于LNP的递送平台对于核酸递送是安全的,且同样适用于各种治疗性货物递送。尽管如此,目前还没有适用于所有疾病的万能解决方案,因此持续性的LNP优化工作依然在进行。
LNP的制备
LNP的制备取决于自组装能力,即脂质成分发生分子间相互作用而自发组织成纳米结构实体。首先,带负电荷的核酸和带正电荷的脂质之间通过静电结合,然后,通过脂质组分之间的疏水作用和范德华作用进行组装,进而形成LNP。由于脂质化学的多样性、核酸的独特性以及两者混合的时间特性,自组装早期阶段的表征和对LNP终性质相关影响的研究依然具有挑战性。LNP制备方案至少会在两方面影响自组装产物:LNP的均匀性和核酸负载效率。
LNP制备方法很多,包括脂质体挤出法、薄膜水化法、纳米沉淀法、微流控以及冲击射流式混合法等。其中,常用的方法是水相和脂质成分快速混合法。微流控法具有良好的重复性,但是对于中试生产而言,微流控通量小,无法实现,辉瑞公司采用的是Knauer的IJM设备,该设备采用冲击式射流混合法,此设备通量大,没有一次性耗材等特点,在这次大规模生产中大放光彩。
LNP配方成分
目前,经典的LNP的脂质成分通常包括四种:可电离脂质(或阳离子脂质)、辅助脂质,胆固醇,聚乙二醇化脂质(PEG-脂质)。
■ 阳离子脂质(CLs)和可电离脂质(ILs)
阳离子脂质(CLs)和可电离脂质(ILs)可通过静电相互作用启动自组装的步。含有阳离子脂质的脂质复合物仍然广泛用于核酸递送。然而,由于毒性问题和缺乏体内效力,已基本被pH响应性可电离脂质所取代。LNP配方中,生理pH下可电离脂质表现为中性,而在内体的酸性环境中则带正电荷。由于有效性和毒性特征的大程度改善,pH依赖性的电离能力使可电离脂质成为核酸递送的合适材料。可电离脂质在配方中的占比通常为总脂质的30%−50%。目前,许多研究致力于微调可电离脂质的性质以进一步提高效率,尤其在难以到达的人体组织中递送效率的提高。阳离子脂质和可电离脂质的整体结构可分为三个部分:(1)头部、(2)连接片段、(3)尾部。
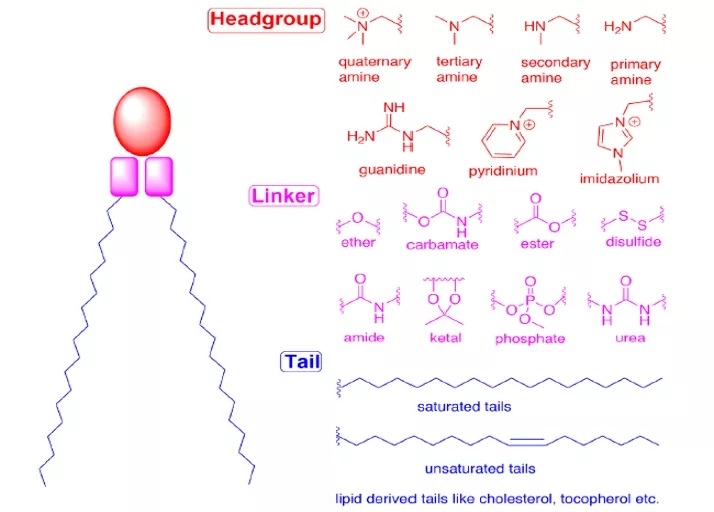
图2:CLs和ILs的整体结构
头部
可电离脂质的头部基团通常带有正电荷。头部基团的大小和电荷密度主要参与包裹核酸,稳定LNP,与细胞膜相互作用及促进内体逃逸等过程。常见的可电离脂质仅包含一个头部基团、有时也包含几个头部基团。典型的头部基团包括胺(伯胺、仲胺、叔胺、季胺)、胍、杂环基团等。临床上使用的可电离脂质(DLin-MC3-DMA, SM-102, ALC-0315)包含叔胺头部、可发生pH依赖性的离子化。ALC-0315和 SM-102的头部基团还含有一个末端羟基,可以减少头部基团的水化作用,提高与核酸的氢键相互作用,从而可能提高转染能力。
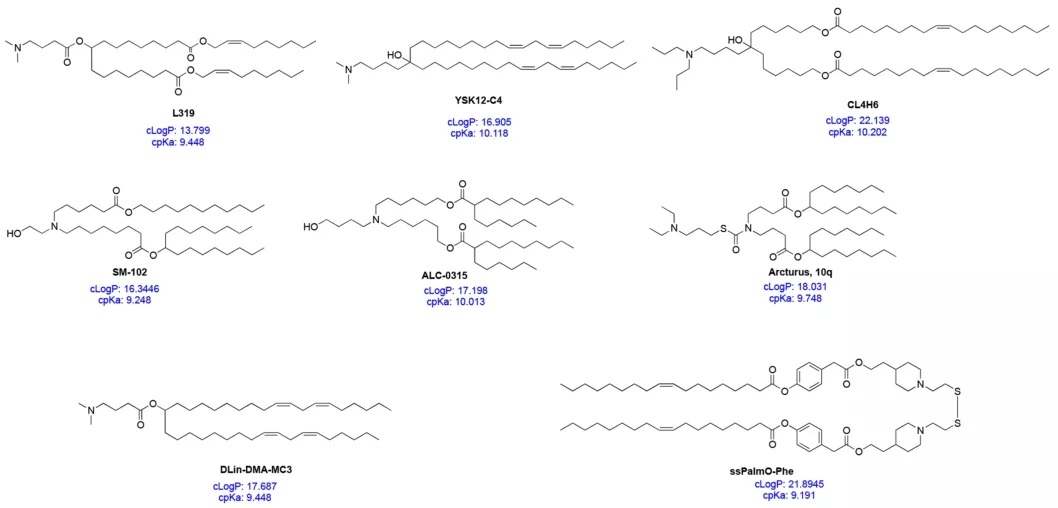
图3:部分ILs的结构、cpKa和cLogP
连接片段
连接片段可以将头部与尾部连接起来,有时连接片段也会隐藏在尾部内(SM-102、ALC-0315)。连接片段会影响LNP的稳定性、生物降解性、细胞毒性和转染效率。常见的连接片段如图2所示。可电离脂质可能包含一个或多个连接片段;而大多数可电离脂质只包含一种类型的连接片段,原因可能是容易合成。连接片段可分为不可生物降解(如醚类和氨基甲酸酯类)和可生物降解(如酯类、酰胺类和硫醇类)两类。生物可降解连接片段是,因为通常可在体内快速清除,可多次剂量使用和减少副作用。DLin-MC3-DMA、ALC-0315和SM-102都含有酯键连接片段。其中SM-102的酯基周围的修饰会影响LNP的清除、配方稳定性和转染效率。
尾部
疏水性尾部会影响pKa,亲脂性,流动性和融合性,从而影响LNP的形成和效力。可电离脂质通常含有1~4条疏水尾部,其中包含8~20个碳原子。尾部可以是饱和/或不饱和的脂肪链,其不饱和程度可通过调节膜不稳定的相关性质影响核酸递送。DLin-MC3-DMA有两条亚油基尾部,而ALC0315和SM-102则有两条分支饱和尾部,被认为具有锥形几何形状,促进内体膜不稳定性和核酸的胞质内释放。
可电离脂质性质
可电离脂质可当作是一种多组分分子,其中每一部分都必须设计,以安全有效地包装和递送核酸。了解可电离脂质的整体特性也有助于下一代可电离脂质的开发和设计。其中计算pKa(cpKa)是主要参数,可以通过计算机容易获得。可电离脂质的cpKa通常为9-10.5。近研究表明,cpKa与实际pKa非常接近。可电离脂质的cpKa可影响相应LNP配方的整体pKa,当可电离脂质的cpKa约为8.5~10.5时,LNP的pKa大约为6~7。可电离脂质的cpKa和LNP的pKa之间的差值似乎是一致的,约为2−4个单位。因此,cpKa可用于指导新型可电离脂质的设计。
可电离脂质的另外两个性质参数是cLogP和cLogD,分别表示分子在非电离和电离状态下的亲脂性。近,Rajappan的工作研究了pKa、cpKa和cLogD对siRNA-LNP递送效率的影响,发现cLogD为10-14的可电离脂质的效果好。因为常见的可电离脂质的cLogP值在15−20的范围内,因此,可电离脂质的亲脂性也应该用于设计下一代可电离脂质。由于可电离脂质的电离性(cpKa)和亲脂性(cLogP)可以影响从与核酸形成初始复合物到终纳米颗粒的形成和货物递送的过程,因此,同时考虑cpKa和cLogP将加速有效可电离脂质的开发。然而,还需要更多的研究来进一步证实这种结论。
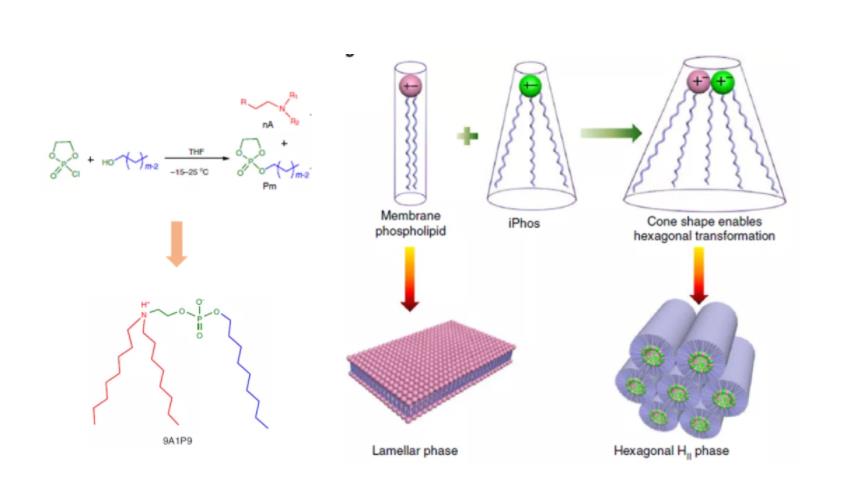
图4:iPhos两性脂质
除了传统的阳离子脂质和可电离脂质外,还有两性脂质。近的一项研究中,Liu等合成了一个包含500多个分子的两性脂质库,称为iPhos。iPhos由胺基、短疏水尾巴和磷酸基团连接片段组成。研究认为带负电荷的磷酸基团促进了膜的融合并诱导了内体逃逸,其中配方9A1P9可以优先将目的核酸递送到肝和肺。
总之,可电离脂质的各部分性质能够影响LNP的整体配方和生物学特性。在过去的50年里,大量的系统性研究致力于设计理想的可电离脂质。其中一些可电离脂质已被FDA批准用于基因货物的递送。然而,还需要大量的研究设计能够高效递送不同类型基因货物的无毒非肝靶向可电离脂质。
■ 胆固醇
胆固醇是一种天然丰富的细胞膜成分,常作为LNP配方的结构脂质。LNP配方中胆固醇占比约20−50%。胆固醇是动物细胞膜的丰富成分,通常从羊毛等天然原料中大量提取。胆固醇在细胞摄取中的作用很长一段时间一直被忽视。研究发现,用天然植物甾醇(如β-谷甾醇和氧化胆固醇衍生物)取代LNP配方中的胆固醇,可以显著改善mRNA的递送,可能由于内吞途径中不同的脂质运输和LNP内体逃逸的增强的结果。虽然目前还不完全清楚为什么含有β-谷甾醇的LNP更有可能逃脱溶酶体途径,但它们的形状多态性和多层结构组织可能会使内体膜变形或延长核酸释放的时间框架。胆固醇主要存在于LNP的外壳,这解释了为什么对固醇结构进行修饰可能会引起LNP表面的组织变化。
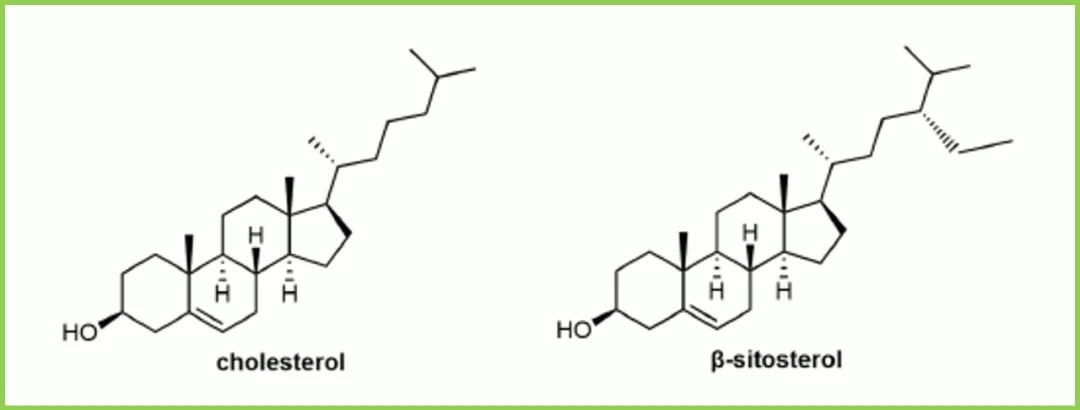
图5:胆固醇和β-谷甾醇
此外,近的研究表明,当接触载脂蛋白E(ApoE)时,胆固醇会从LNP核心转移到脂质外壳上。这些结果表明,与可电离脂质相比,虽然胆固醇相对惰性,但胆固醇及其衍生物可能影响细胞识别途径。然而,关于LNP配方中胆固醇的修饰,仍然存在许多未知和挑战。例如,植物甾醇没有胆固醇那么丰富,供应稀少,生产成本高,可能会阻碍它们在LNP配方中的应用;原料的性质和相应的痕量杂质可能会导致LNP的批次差异性。固醇和脂质的立体化学也可能对LNP配方产生潜在影响,如立体化学是否会影响脂质的识别、运输和循环利用? 不同对映体在LNP表面的脂质堆积是否有显著差异? 这些问题的答案需要进一步的研究探索。
■ 磷脂
磷脂有助于包裹核酸和稳定LNP。与其他组分相比,针对于它们的研究相对较少,通常配方中占比为总脂质的10%−20%。磷脂通常也作为LNP配方的结构脂质,因为它们可以自发地组织成脂质双层,且较高的相变温度增强LNP的膜稳定性。与细胞膜类似,磷脂位于LNP的外围。这些脂质通常是半合成的。例如,磷脂酰胆碱通常来源于蛋黄和大豆等天然原料,并且可以进行化学修饰(如增加脂肪酸尾巴)。

图6:DSPE、DOPE和DGTS的结构
1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(DSPC)是一种临床用于siRNA疗法Onpattro和SARS-CoV-2 mRNA疫苗的LNP中的结构脂质。DSPC的结构由磷脂酰胆碱头部基团和两个饱和的18碳尾部组成,两个尾巴形成紧密堆积的脂质双层。在LNP中,DSPC主要位于纳米粒子表面和在纳米粒核心中的较为边缘位置。1,2二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)是另一种常用于LNP临床前研究的磷脂。DOPE的不饱和尾巴不仅形成了更具流动性的脂质层,而且能够形成六角相(HII)的组织形式,HII相能够促进脂质膜与内体膜的融合,导致核酸的胞质释放。
一些研究表明,与DSPC相比,DOPE-LNP可以提高RNA的转染效率。近Zhang等报道,静脉给药后,包含DOPE的C12-200 LNP可在肝脏中积累,而包含DSPC的C12-200 LNP则在脾脏中积累,证明了结构脂质对LNP生物分布的影响。Sahay等发现在MC3-LNP中,用天然糖脂替代DSPC会影响mRNA的转染效率,植物来源的膜脂质1,2二棕榈酰-sn-甘油-3-o-4'-(N,N,N-三甲基)高丝氨酸(DGTS)随着不同给药途径具有不同的转染效率。总之,这些研究表明结构脂质在基于LNP的RNA递送中具有重要作用。
■ PEG修饰脂质
PEG修饰的脂质(PEG-脂质)是LNP中调控半衰期和细胞摄取的一个重要组分。LNP组装时,由于亲水性和大体积,PEG链位于纳米粒子的外壳上。与其他纳米载体一样,PEG为LNP提供了一个外部聚合层,以阻止血清蛋白吸附和单核吞噬细胞系统的摄取,延长了体内的循环时间。PEG还可以防止纳米颗粒在储存过程和血液中的聚集。此外,PEG-脂质的数量可能决定颗粒的大小。PEG-脂质的另一个潜在目的是实现LNP的表面功能化。功能化的PEG-脂质可以将LNP与配体或生物大分子生物偶联。例如,Singh等使用DSPE-PEG-胺与透明质酸偶联,实现肿瘤靶向;Parhiz等采用DSPE-PEG-马来酰亚胺与抗体偶联。虽然PEG对LNP的稳定性和生物偶联具有重要意义,但其解吸对细胞转染也至关重要。PEG从LNP中脱落的PEG可以通过血清蛋白(如载脂蛋白和白蛋白)进行调理,这些蛋白是LNP的受体介导的内吞作用的关键效应因子。Akinc等证实ApoE与LNP结合,实现低密度脂蛋白受体(LDLR)介导的肝细胞内化。
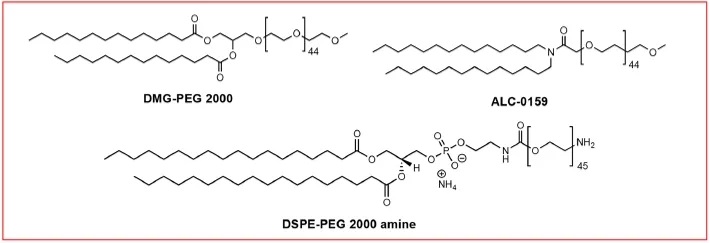
图7:PEG-脂质结构
由于PEG-脂质能够抑制ApoE与LNP的结合,过量的PEG-脂质对LNP的细胞摄取和转染可能产生不利影响。由于与ApoE容易结合,含有较少PEG-脂质的LNP似乎更有效递送核酸。PEG-脂质的脂链长度也是决定解吸速率的重要因素。Mui等报道,PEG从LNP膜上的脱落程度与PEG-脂质中脂链的长度成反比,因为PEG-脂质和LNP膜之间的疏水相互作用随着PEG-脂质的脂链长度的增加而增加。
Suzuki等认为PEG脱落速度也可能影响抗PEG抗体的产生,并造成重复给药的并发症。静脉注射用的LNP配方中PEG-脂质含量很少超过2%。然而,致密的PEG层可能有利于实现肝外靶向。Lee等研究表明,含有5%的PEG-脂质的LNP肿瘤积累高于含有2.5%的PEG-脂质的LNP。Lokugamage等证明PEG-脂质对于雾化LNP的递送至关重要。因此,LNP中PEG-脂质的数量和类型可能需要根据临床需要进行仔细调整。
LNP性质
LNP的平均粒径和粒径分布是LNP质量和各种应用适宜性的重要初始决定因素。这些特征通常通过动态光散射(DLS)进行表征。通常,LNP的佳粒径为20−200nm,因为这个大小使LNP足够牢固以承受流体流动(如血液和淋巴),同时允许LNP穿过间质。LNP大小通常通过改变PEG-脂质的量或混合参数(如流速和体积比)来调节。LNP的大小可能会影响LNP的内化、生物分布、降解和清除,且不同的应用可能需要不同的粒径大小。例如,小鼠模型中,皮下给药时,45nm-siRNA-LNP的递送效率好,而静脉给药时,80nm-siRNA-LNP则有效。然而,在啮齿动物和非人灵长类动物中对不同mRNA-LNP粒径大小的比较表明,当肌肉注射LNP时,非人灵长类动物对粒径大小并没有那么敏感。
LNP的表面电荷负责与细胞膜和生物环境发生相互作用。因为细胞膜带负电荷,表面带负电荷的LNP会与细胞膜产生排斥,不会被细胞吸收。另一方面,带正电荷的LNP可能会直接破坏细胞膜,造成细胞毒性。这是可电离脂质在LNP设计中至关重要的原因:初,含有可电离脂质的LNP是电中性的,可以避免任何不必要的静电相互作用,但在内体酸性pH时会获得正电荷。通常通过Zeta电位测量来评估LNP的表面电荷。这种技术通常用于评估胶体的聚集。虽然没有严格的分类,但如果zeta电位在−20和+20 mV之间,则认为表面电荷较弱。
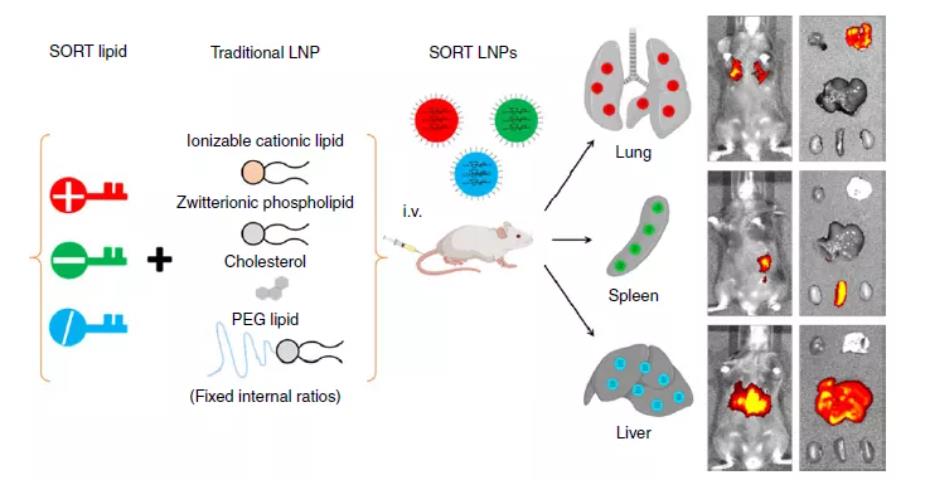
图8:SORT-LNP
调节LNP表面总电荷的一种常用方法是调节N/P比值,即可电离脂质(N,代表阳离子胺)与核酸(P,代表阴离子磷酸)的比值。Carrasco等报道在含有可电离脂质KC2的LNP中,增加N/P比可以增加表面电荷和包封率。此外,将永久带电的脂质引入LNP中可能会改变器官的优先摄取倾向,且不增加表面电荷。Cheng等在小鼠中实现了基于脂质电荷的选择性器官靶向(SORT):在LNP配方中添加带正电的脂质会优先靶向肺组织转染,而带负电的脂质则直接优先靶向脾脏转染。
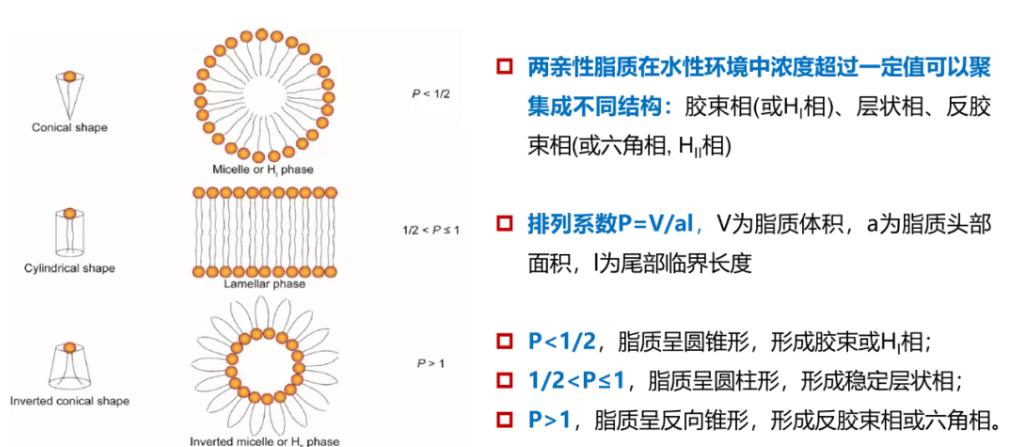
图9:脂质的形状结构
脂质堆积可能会影响许多参数,从膜的水化和变形能力到细胞摄取和货物释放。简而言之,每种脂质都可以用一个取决于极性“头”和非极性“尾”所占体积的堆积参数来描述。结构均匀的脂质形成圆柱形结构和层状相,而不均匀脂质则形成六角相、立方相和胶束相。反六角相(HII)似乎显著地促进了脂膜的融合。目前,在RNA-LNP递送领域,非层状相的可控制备相对少见,如立方相。然而,当存在环境触发因子时,LNP可能会发生结构变化。Heyes等利用31P NMR波谱研究了含有一系列带有不同脂质尾部的阳离子脂质的脂质颗粒的相变行为发现,从层状到六角转变温度(TBH)较低的脂质更易于发生膜融合,终的基因沉默效率也证明了这一结果。
同样,膜不稳定理论提出,由于可电离的脂质暴露于晚期内体的酸性pH环境下,可电离脂质和内体膜中的磷脂之间的静电相互作用导致膜破裂。Liu等近的一项工作利用这一概念,报道了当一种新型可电离脂质暴露于模拟内体时,由31P NMR谱显示六角相形成的证据。虽然pH诱导结合是脂质材料常见的机制,但相关报道也提出其他导致内膜不稳定的方法。
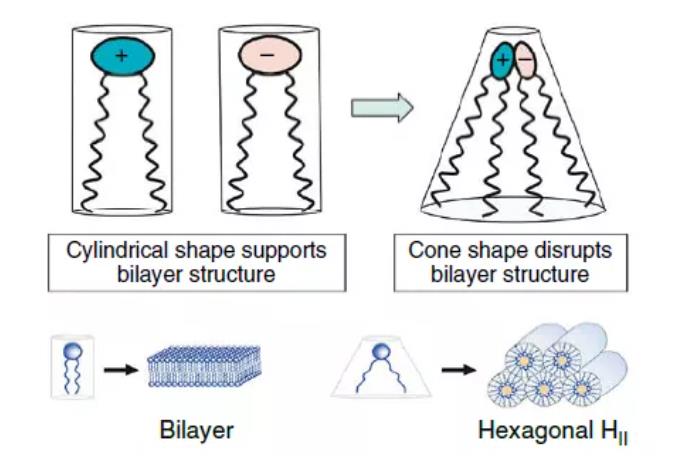
图10:可电离脂质实现膜不稳定
根据脂质相和整体极性的不同,脂膜可能会夹带水分,从而改变膜的流动性或变形性,进而影响脂膜融合。膜水合作用也可能影响对pH的潜在响应性,pH是一种关键的环境触发因素,通常用来启动核酸的释放。LNP在其生命周期中遇到的pH变化如图11所示。当LNP进入细胞内空间时,会被困在内体中,而内体在成熟为溶酶体时逐渐酸化。因此,脂膜中较高的水分含量可能会影响酸化动力学,并有助于膜的快速失稳。Koitabashi等用Laurdan分析法检测siRNA-LNP中脂膜的失稳对pH的响应,发现膜水合作用与基因沉默效率呈正相关。
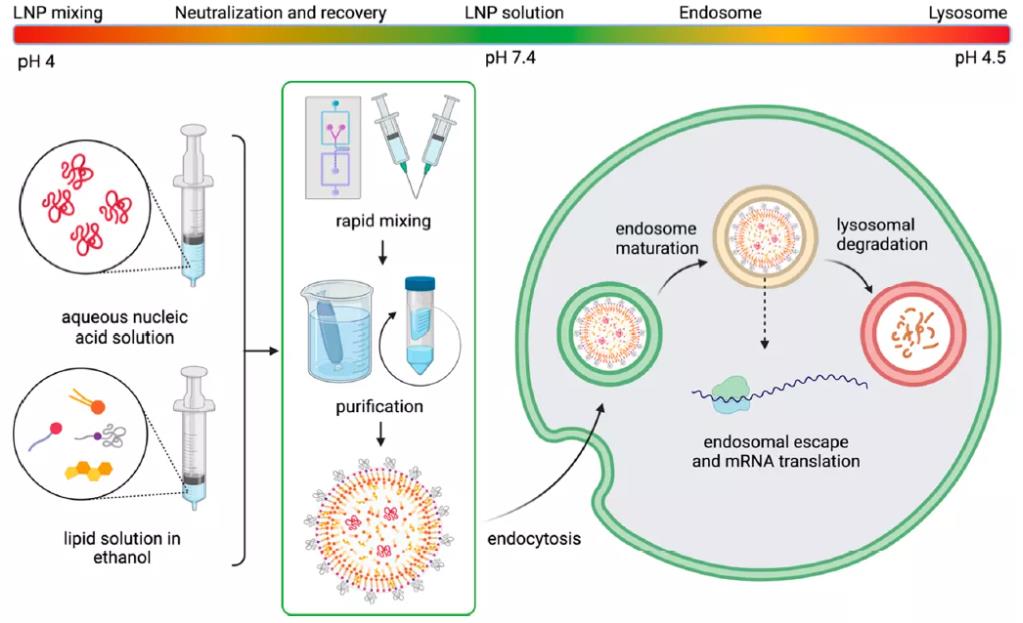
图11:LNP在其生命周期中遇到的pH变化
关于膜水合作用的一个有趣的观点是,由31P NMR实验证明了siRNA-LNP的含水量比相同配方的mRNA-LNP的含水量要少,这可能是由于亲水性mRNA链的长度更长的结果。这些结果进一步证实了Carrasco等的观点,他们发现到低N/P比的KC2-LNP每个纳米粒包含更多的mRNA和脂质,且具有较高的介电常数,表明低N/P比的LNP比高N/P比的LNP发生更多的水化作用,更高的RNA溶剂化也进一步提高转染效率。mRNA-LNP可能对环境变化更加敏感,尽管pH敏感性的变化可能与生物过程的时间尺度无关。暴露于生物环境中的重组使LNP外壳的水化问题进一步复杂化。
LNP固有的水环境也对其长期稳定性构成了威胁。在正常环境条件下,纯核酸可以通过外源RNase降解或自水解迅速变质。虽然LNP可以保护核酸不被酶降解,但由于热力学因素(如小化相分离),LNP倾向于聚集,导致核酸在纳米粒子融合时丢失,终影响转染效率。低温储存和冷冻干燥可能会保存RNA,但会由于形成冰结晶而破坏LNP,加入蔗糖等冷冻保护剂似乎可以缓解这一问题。有趣的是,LNP可能会根据储存条件改变它们对器官的优先摄取,这可能是由于它们发生重组的结果。
值得注意的是,Pfizer/BioNTech和Moderna疫苗的储存条件要求不同,这表明LNP配方的变化可能会显著改变核酸亲和力和LNP稳定性。目前还没有确定的方法来加速这些非晶体材料的稳定性测试,意味着必须在离散的时间点对稳定性进行经验评估,如差示扫描量热法(DSC)等热方法可能为LNP降解提供有价值的测定。终,需要对LNP自组装有更好的了解,才能预测基于LNP的RNA疗法的下游特性。
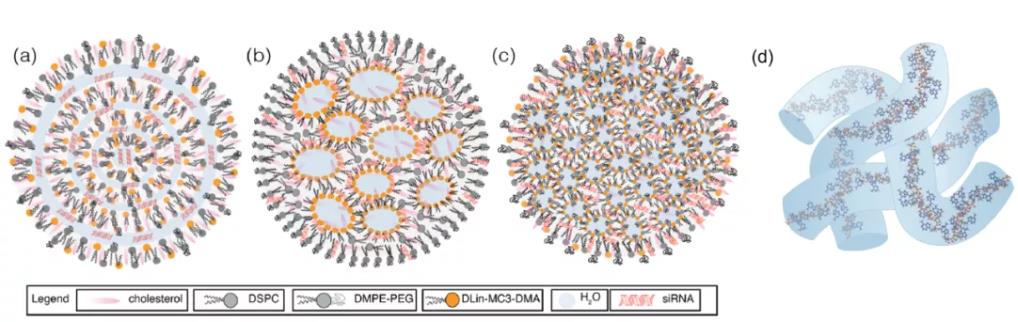
图12:siRNA-LNP的结构。(a)多层囊泡;(b)纳米结构核心;(c)均质核壳;(d)mRNA水柱
目前,LNP的内部组织结构问题还没有得到解决。一些报道表明,siRNA-LNP具有一种“夹心”结构,其中siRNA与LNP外部的脂质层相互作用。另一方面,mRNA也可能沿着LNP边缘拉伸,占据“水泡状”LNP内部的水-脂界面,或者占据相互连接的水通道,在水通道中,mRNA可能由于亲水性而发生移位。mRNA也可能从大部分脂质中转移到水泡中。近,Sahay等利用cryo-TEM的研究表明,任何偏离均匀的,球形的LNP(如,多态形状,多层结构,或水泡)都可能提高mRNA转染效率。然而,目前还不清楚改进后的转染是否受到脂质成分分子识别的影响。
脂质组织的变化也可能受到溶解度的影响。虽然脂质通常在混合前通过加热或超声波进行溶解,但Yanez Artla等报道利用小角X射线散射法检测到LNP脂膜中存在胆固醇晶体。脂质组织也可能在暴露于生物环境时改变,当暴露于血清中丰富的蛋白质ApoE时,LNP在表面和核心都发生了重组。围绕RNA递送中脂质组织的悬而未定的问题需要进一步研究。
纳米粒子容易与蛋白质发生非特异性吸附,进而在界面处形成生物分子冠。纳米粒子表面生物分子冠的形成改变了纳米粒子的表面性质和理化特性,在纳米颗粒的生物分布和吞噬作用中发挥重要作用。ApoE是生物分子冠的组成部分,它影响LNP介导的核酸递送。ApoE主要通过肝细胞合成,在肝脏中含量丰富,这是为什么静脉注射的LNP通常会进入肝脏的部分原因。ApoE通过形成脂质复合物并将其转运到表达低密度脂蛋白受体(LDLR)的细胞,促进LDLR介导的内吞作用,内在地参与胆固醇代谢。这个概念也适用于LNP,Akinc等证明在缺乏ApoE或LDLR的情况下,与正常条件相比,含有可电离脂质KC2的LNP的细胞摄取显著降低。Dong报道,含有cKK-E12(一种可电离脂质)的LNP在ApoE存在的情况下可以更有效地进入细胞。
LNP配方中的其他脂质也可能与ApoE与LNP结合有关。Zhang等报道LNP中其他脂质成分相同的情况下,DOPE与ApoE的相互作用大于DSPC,表明磷脂结构的变化改变了ApoE与LNP的结合亲和力。Sebastiani等报道称,ApoE在mRNA-LNP上的吸附导致纳米粒子中脂质成分的重排,当暴露于ApoE时,部分胆固醇从纳米颗粒核心重新定位到外壳上。Kim等报道了PEG含量的改变和PEG-脂质与甘露糖的结合可以控制mRNA在肝脏中的细胞特异性递送。有趣的是,ApoE在大脑和中枢神经系统中也很丰富,星形胶质细胞可以产生ApoE。Tanaka等探索通过脑室注射向小鼠递送mRNA-LNP,发现星形胶质细胞成功地摄取了ssPalm-LNP。
ApoE并不是已知的与细胞摄取差异相关的蛋白质。近,Miao等人证实血清白蛋白允许LNP通过一种ApoE非依赖性的途径进入细胞,表明了其他血清蛋白的重要性。尽管有许多的研究结果,但如何充分利用生物分子冠的潜力尚不清楚。生物分子冠负责免疫系统对LNP的识别、血液循环时间和生物分布,找到控制分子冠成分的方法可以实现细胞、组织或器官的特异性摄取。
总结
LNP是一种可高度个性化设计的核酸递送载体,在mRNA疫苗递送中显示出巨大潜力。此外,LNP在罕见病和癌症治疗方面的潜在价值也不容忽视。mRNA疗法可以帮助产生治疗性蛋白质,以恢复受损组织或器官的功能。全球范围内已经进行了大量的研究设计和完善LNP的单个组分,以便高效、安全地递送目标核酸。
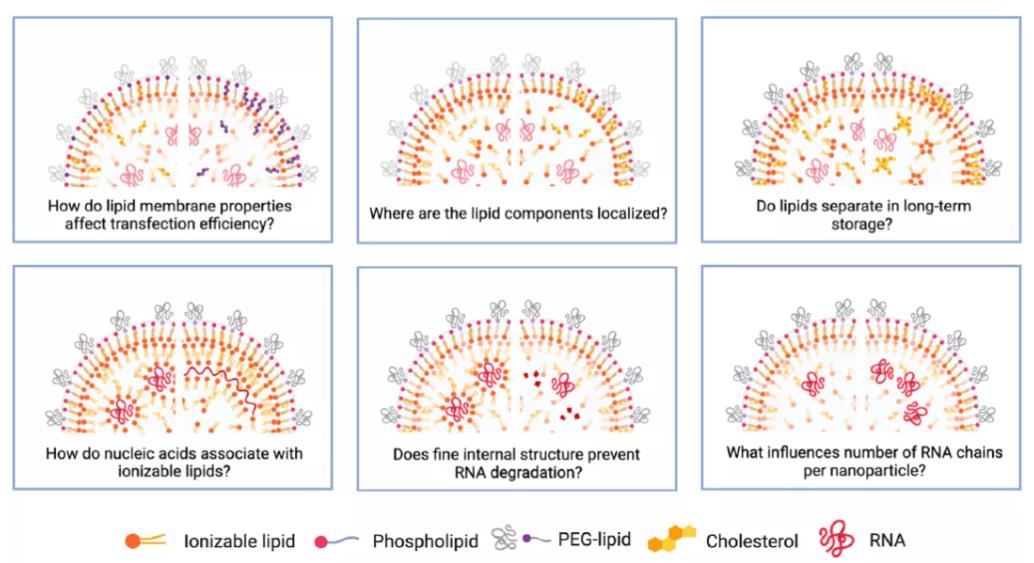
图13:LNP依然未能解决的问题
然而,LNP还有许多悬而未决的问题,例如,脂质膜的性质如何影响转染效率?各脂质组分在LNP中的定位?长期储存时脂质的分离?核酸如何与可电离脂质相互作用?LNP内部结构如何防止核酸降解?什么因素影响每个LNP中的RNA数量?随着公众对mRNA疫苗关注的激增,相关的研究工作将快速发展,进而开启纳米医学新时代。
参考文献:
1.YuliaEygeris, Mohit Gupta, Jeonghwan Kim, Gaurav Sahay.Chemistry of LipidNanoparticles for RNA Delivery. Acc. Chem. Res. 2022, 55, 2-12.
2. Yuebao Zhang, Changzhen Sun, Chang Wang, Katarina E. Jankovic, and Yizhou Dong. Lipidsand Lipid Derivatives for RNA Delivery. Chem. Rev. 2021, 121, 12181-12277.
3. LindeSchoenmaker, Dominik Witzigmann, Jayesh A. Kulkarni, Rein Verbeke,
GideonKersten, Wim Jiskoot, Daan J.A. Crommelin. mRNA-lipid nanoparticle COVID-19vaccines: Structure and stability. Int. J. Pharm. 2021, 601, 120586.






